Mostrando artículos por etiqueta: Cromatografía de Gases
Intoxicación con Fosfuro de Aluminio
Comparación de dos métodos de detección
Se implementó una metodología para la detección de Fosfina mediante Cromatografía de Gases con Detector de Nitrógeno y Fósforo acoplado a Headspace, por sus siglas en inglés, GC/NPD –HS-, posteriormente se evaluó límite de detección, selectividad y precisión del método. Además se comparó la técnica de Scherer y GC/NPD –HS- para determinar cual tiene mayor confiabilidad, precisión y sensibilidad y así usarla en el análisis de casos de intoxicación.
El Fosfuro de Aluminio o de Zinc, son utilizados como plaguicidas en países agrícolas como Guatemala, y tienen la característica que al contacto con el agua o pH ácido reacciona formando el gas Fosfina (PH3). Ésta reacción se da en los casos de intoxicaciones por Fosfuro, siendo el gas Fosfina el causante de la intoxicación, puesto que actúa sobre el sistema nervioso central y el gastrointestinal provocando vómitos, ataxia, convulsiones, coma y hasta la muerte, normalmente 2 horas después de su ingestión, en casos severos.
Para los años 2012 y 2013 en el Laboratorio de Toxicología del Instituto Nacional de Ciencias Forenses de Guatemala la detección de Fosfina fue de un 21% del total de casos analizados como intoxicación. Tomando en cuenta dicho porcentaje, se implementó una metodología para su detección mediante Cromatografía de Gases con Detector de Nitrógeno y Fósforo acoplado a Headspace GC/NPD –HS-. El detector de Nitrógeno y Fósforo se caracteriza por ser más sensible y selectivo para moléculas que contengan en su estructura nitrógeno y fósforo.
Para el método se evaluaron los siguientes parámetros: límite de detección, selectividad, precisión donde se evaluó repetibilidad y precisión intermedia, con el objeto de determinar que los resultados obtenidos del mismo son confiables y con validez científica. También se llevó a cabo la comparación entre la técnica de Scherer, utilizada actualmente en el Laboratorio de Toxicología para detección de Fosfina y el método de GC/NPD –HS-.
MATERIALES Y MÉTODOS
Universo de trabajo
Muestras biológicas de contenido gástrico que ingresan al Laboratorio de Toxicología con historia de intoxicación por sustancia tóxica del período comprendido de Enero - Febrero de 2014.
Recursos Materiales
- Material de Laboratorio: Arandelas de aluminio, Viales de vidrio de 10 mL, Pipetas con émbolo de volumen variable de 10-100 µL, micropipetas de plástico, Espátulas de acero inoxidable, Papel pH y Papel filtro Whatmann No. 1.
- Equipos: Cromatógrafo de Gases con detector de Nitrógeno y Fósforo y automuestreador tipo Headspace, Balanza semianalítica y plancha de calentamiento.
- Reactivos: Ácido acético glacial GR, estándar de referencia secundario de Fosfuro de Aluminio (Photoxin ®), solución de Nitrato de plata saturada en metanol, solución de Acetato de plomo trihidratado al 10%, solución de Ácido tartárico 10 %.
METODOLOGÍA
La implementación de la metodología de análisis por GC/NPD -HS- y la comparación con la técnica de Scherer constó de 4 fases:
- Se establecieron a través de pruebas las condiciones cromatográficas, las del detector y del automuestreador, las óptimas para la detección de fosfina son las siguientes: temperatura del horno 70º C con una rampa de 15.00º C/1 min y post run 100º C/0.50 min., temperatura de puerto de inyección de 320º C, modo split 15:1, Columna HP-5 30 um x 320 um x 0.25 um con flujo constante 0.8 mL/min. temperatura de Headspace 70º C, al cual se nombró método “Fosfina.M”.
- Para la preparación de las muestras a analizar en GC/NPD-HS- se necesita 1 mL de muestra con contenido gástrico o estándar de referencia secundario de fosfuro de aluminio y acidificar la muestra con 100 µL de ácido acético glacial.
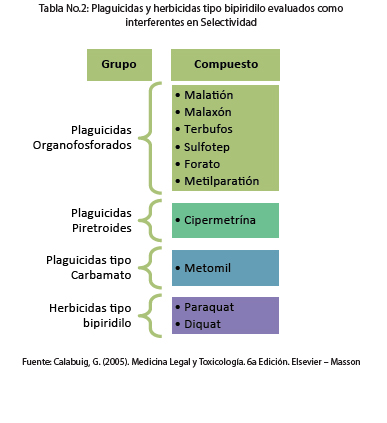
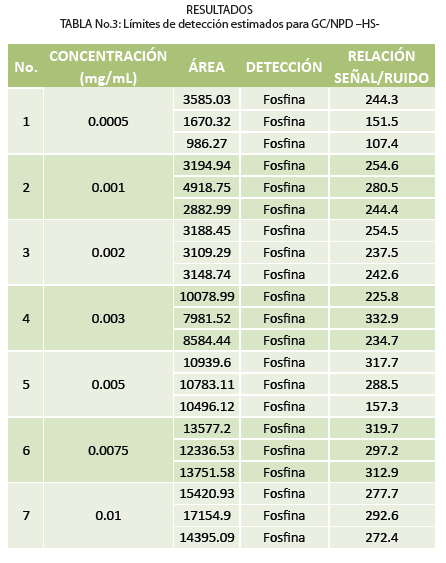
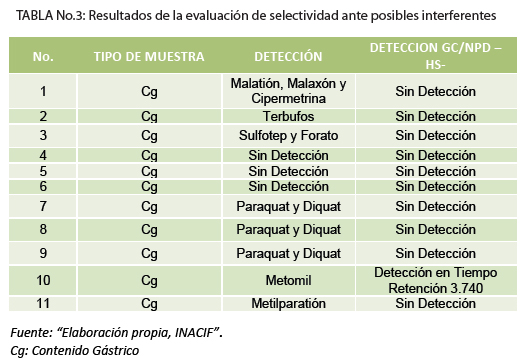
- Se evaluó para la metodología GC/NPD –HS- implementada los siguientes parámetros: límite de detección, selectividad, precisión (repetibilidad y precisión intermedia). Para límite de detección se evaluó la proporción señal/ruido, para lo cual se prepararon tres diluciones a partir de estándar de referencia secundario de Fosfuro de Aluminio a siete concentraciones desde 0.0005 mg/mL a 0.00100 mg/mL diluidas en agua destilada, hasta detectar la concentración mínima con una señal/ruido arriba de 3. Para selectividad se analizaron muestras de contenido gástrico, a los cuales previamente se había detectado plaguicidas organofosforados, carbamatos y piretroides; herbicidas bipiridilo, además se analizó la matriz biológica (contenido gástrico) libre de drogas o tóxicos.
- Para su aceptación no debía existir respuesta analítica (señal) en el tiempo de retención caracterizado 3.560 ± 0.5%. Para precisión se evaluó repetibilidad y precisión intermedia. En la repetibilidad se prepararon tres diluciones de estándar de referencia secundario de Fosfuro de Aluminio a siete concentraciones distintas desde 0.0005 mg/mL a 0.00100 mg/mL en agua destilada, las cuales fueron analizadas el mismo día por un mismo analista. En la precisión intermedia se analizaron por un período de dos meses un total de 64 muestras de contenido gástrico de casos que ingresaron al Laboratorio de Toxicología del Instituto Nacional de Ciencias Forenses de Guatemala con sospecha de intoxicación por tóxicos, los cuales fueron analizados por distintos peritos.
El mayor porcentaje de intoxicaciones según estadísticas del periodo comprendido de los años 2012 y 2013 realizadas en el Laboratorio de Toxicología del Instituto Nacional de Ciencias Forenses de Guatemala, es por intoxicación con Fosfuro. Este tipo de intoxicación es el resultado de la ingestión accidental o suicida de Fosfuro de aluminio también conocido como Photoxin ® o Fosfuro de zinc (Phosvin ®), los cuales son agentes insecticidas empleados para proteger alimentos o granos, de plagas. El Fosfuro es altamente tóxico para el ser humano, al ser ingerido reacciona con el agua y el ácido del estómago, produciendo fosfuro de hidrógeno también conocido como Fosfina, que por su carácter gaseoso afecta principalmente los órganos del aparato respiratorio dando origen a bronquitis irritativa, hipersecreción bronquial y edema pulmonar (Kaye, 2008).
El análisis para la detección de Fosfina por el método de Cromatografía de Gases con Detector de Nitrógeno y Fósforo –NPD- acoplado a automuestreador de volátiles Headspace –HS-, consiste en colocar la muestra acidificada en un recipiente hermético, e incubarla en el automuestreador, hasta lograr el equilibrio entre la fase de vapor y la muestra, permitiendo que las sustancias volátiles contenidas incluyendo la Fosfina se volatilicen. Luego la fase de vapor es inyectada en el cromatógrafo donde se lleva a cabo la separación de los componentes volátiles que se reparten entre la fase móvil (gas acarreador) y la fase estacionaria (columna), para posteriormente llegar al detector NPD, el cual se caracteriza por ser altamente sensible y específico a compuestos que en su estructura contienen átomos de nitrógeno y fósforo.
Los parámetros evaluados para el método de GC/NPD -HS- implementado, fueron realizados según lo especificado para método cualitativo, los cuales fueron: límite de detección, selectividad, y precisión como repetibilidad y precisión intermedia. Según resultados obtenidos el límite de detección
fue de 0.0005 mg/mL, concentración más baja que se pudo medir y en la cual se obtuvo una señal/ruido arriba de 3. El detector de Nitrógeno y Fósforo tiene una alta sensibilidad para átomos de nitrógeno y fósforo, por lo que los límites de detección son abajo, en muestras con alta cantidad de fosfuro se debe de realizar una dilución de 1 mL: 10 mL de agua, para evitar arrastre y contaminaciones.
Para la evaluación de la selectividad, se determinó que los productos de la matriz (contenido gástrico), plaguicidas y herbicidas tipo bipiridilo nombrados en tabla No.2, no conducen a una detección equívoca de Fosfina, puesto que no hubo detección en el tiempo de retención estimado para la Fosfina (3.560 ± 1%). Únicamente hubo respuesta para Metomil pero en un tiempo de retención 3.740, por lo que no hay falsos positivos para Fosfina.
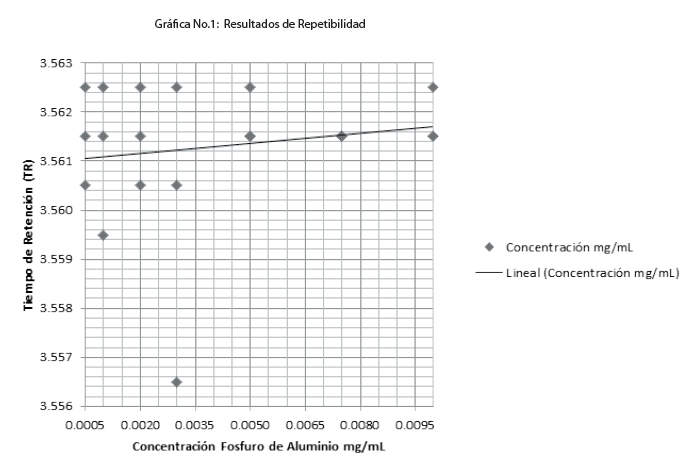
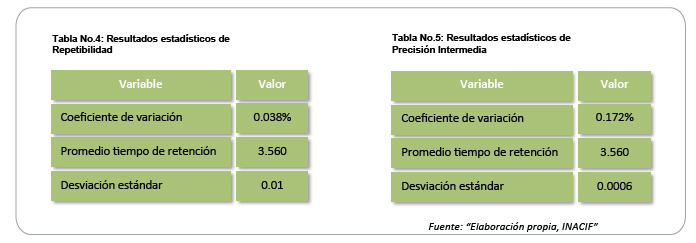
En la gráfica No.1, se representan los resultados de la evaluación de Repetibilidad del método de Fosfina, donde se obtuvieron resultados consistentes que reflejan que no existe variación significativa en cuanto a los tiempos de retención, puesto que el coeficiente de variación no sobrepasa el 2.0% (ver tabla No.4). Es importante resaltar que en condiciones homogéneas de análisis y en un período corto de tiempo, los resultados obtenidos no presentan variación significativa, obteniendo resultados confiables.
En la tabla No.5 se observan los resultados de Precisión Intermedia en donde el coeficiente de variación también estuvo debajo del 2 % por lo que el método no presenta variaciones en un período largo de tiempo, ni importando quien realice el análisis; a través de la evaluación de selectividad se reafirma que los resultados obtenidos en casos de intoxicación donde se tenga sospecha de ingesta de fosfuro de aluminio son confiables.
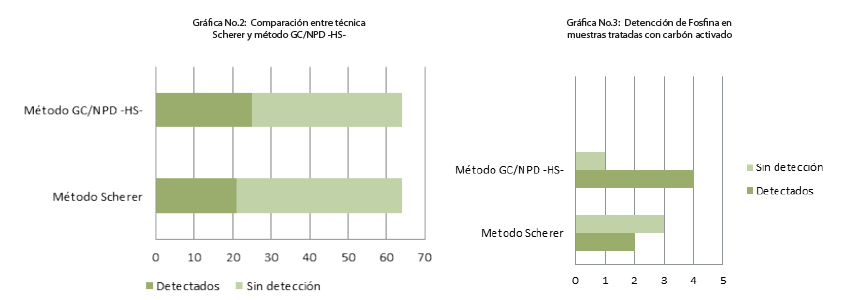
Por último, se comparó la técnica de Scherer y el método de detección de Fosfina por Cromatografía de Gases con Detector de Nitrógeno y Fósforo –NPD- acoplado a automuestreador de volátiles Headspace –HS-, en donde se analizaron un total de 64 muestras de contenido gástrico, que ingresaron al Laboratorio de Toxicología del Instituto Nacional de Ciencias Forenses de Guatemala -INACIF- en el periodo de enero a febrero de 2014 con historia de intoxicación. Como se observa en la gráfica No.2 el método GC/NPD –HS- tiene la capacidad de detectar Fosfina en concentraciones menores que la técnica de Scherer, donde se obtuvieron resultados cuestionables, además el método de GC/NPD –HS- logró la detección de Fosfina en muestras procedentes de intoxicaciones que habían sido tratadas con carbón activado (ver gráfica No.3). El carbón activado es utilizado por sus propiedades adsorbentes, lo que disminuye la cantidad en este caso de Fosfuro de Aluminio contenido en la muestra.
La técnica de Scherer se basa en el principio de óxido reducción, en la cual la Fosfina se interpreta como positiva o negativa al observar la reacción de la Fosfina con el nitrato de plata al 10%, como un precipitado gris sobre el papel que se denomina como “espejo de plata”, siendo un análisis subjetivo al ojo del analista, dando confusión en la interpretación de los resultados. Mientras que el GC/NPD –HS- por el tipo de detector es hasta 500 veces más sensible al Fósforo que un detector de ionización de llama –FID-, por lo que las concentraciones que logra detectar son menores.
- El método de detección de Fosfina por Cromatografía de Gases con detector de Nitrógeno y Fósforo acoplado a automuestreador tipo headspace, es el método más confiable para su detección en muestras de contenido gástrico por ser selectivo y tener alta sensibilidad.
- Los productos de la matriz de contenido gástrico, matrices que contienen plaguicidas organofosforados (Malatión, Malaxón, Cipermetrína, Terbufos, Sulfotep, Forato, Metomil, Metilparatión), herbicidas tipo biperidilo (Paraquat y Diquat), no conducen a una detección equivoca de la fosfina.
- El método de detección de Fosfina por Cromatografía de Gases con Detector de Nitrógeno y Fósforo –NPD- acoplado a automuestreador de volátiles Headspace –HS-, tiene un coeficiente de variación no mayor de 2.0%, por lo que cumple con Repetibilidad.
- El método de detección de Fosfina por Cromatografía de Gases con Detector de Nitrógeno y Fósforo –NPD- acoplado a automuestreador de volátiles Headspace –HS-, tiene una precisión intermedia no mayor de 2.0 % por lo que cumple.
- El método de detección de Fosfina por Cromatografía de Gases con Detector de Nitrógeno y Fósforo –NPD- acoplado a automuestreador de volátiles Headspace –HS- es más sensible y selectivo que la técnica de Scherer.
BIBLIOGRAFÍA
- Baselt, R. (2000) Disposition of Toxic Drugs and Chemicals in Man. Fifth Edition Foster City: Chemical Toxicology Institute. U.S.A.
- Calabuig, G. (2005) Medicina Legal y Toxicología. 6a Edición. Elsevier – Masson. España. Pp.1416.
- Kaye, S. (2008) Handbook of Emergency Toxicology. A Guide for the Identification, Diagnosis, and Treatment of Poisoning. Fifth Edition. Charles C Thomas Publisher. U.S.A.
- OPS et al (1999) Diagnóstico, tratamiento y prevención de enfermedades agudas causadas por plaguicidas. UNED. San José, Costa Rica C.A
Licda. Dolly Rocío Salguero Recinos
Química Farmacéutica, Universidad de San Carlos de Guatemala
Número de colegiada: 4026
Estudios de Maestría en Administración de Industrias y Empresas de Servicio, Universidad de San Carlos de Guatemala
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Post Populares
-
Envenenamiento por Estricnina: Correlación entre los hallazgos de necropsia y resultados de análisis toxicológico
-
¿Harina o Cal? Análisis Forense para diferenciar a través de Espectrometría de Infrarrojo con Transformadas de Fourier y Microscopía Electrónica de Barrido.
-
La Identificación Humana Forense
Tag de publicaciones
INACIF
Somos una institución con autonomía funcional e independiente que surge como consecuencia de la necesidad de unificar y fortalecer los servicios periciales forenses en Guatemala, mediante el desarrollo científico del trabajo que realiza como institución autónoma, garantizando la imparcialidad y confiabilidad de la investigación técnica científica, contribuyendo así al sistema de justicia.
DIRECCIÓN SEDE CENTRAL
14 calle 5-49 zona 1, Guatemala
TELÉFONO SEDE CENTRAL 14 CALLE
(502)-23273100
Ver Directorio Telefónico Institucional