
En el proceso de investigación se utilizaron 20 clases de textiles, los cuales fueron impregnados con una muestra de referencia de semen de origen humano, aplicado tanto sin diluir como en diluciones seriadas de 1:2 hasta 1:256. Posteriormente los textiles fueron expuestos a lámparas de luz azul y Ultra Violeta (UV), observándose fluorescencia en las áreas donde se depositó la muestra de semen de referencia sin diluir y a la dilución 1:2 utilizando ambos tipos de lámparas, excepto para el lino sintético con ambos tipos de luz y en la entretela de lana específicamente con la lámpara de luz UV, en los cuales únicamente se observó fluorescencia en las áreas con muestra de semen sin dilución.
El dacrón seda fue el único textil que presentó fluorescencia en todas las diluciones y con ambos tipos de luz. El estudio permitió comprobar la utilidad de ambas técnicas para la búsqueda presuntiva de fluido seminal, determinando una mayor sensibilidad de la técnica que emplea lámparas de luz azul, en un factor de 1:2 en 6 de los 20 textiles incluidos en el estudio.
El semen es un fluido viscoso de color blanquecino, producido por los órganos reproductores masculinos. Contiene proteínas, minerales, fructosa, mucina, espermatozoides, entre otros. Es expulsado a través de la uretra durante la eyaculación.
En los laboratorios de análisis forense, la detección de fluido seminal se efectúa en indicios recolectados durante los procedimientos médicos y/o en escenas del crimen; es un análisis de suma importancia cuando existe la sospecha de que ha ocurrido un delito sexual.
En el Instituto Nacional de Ciencias Forenses de Guatemala -INACIF-, este análisis se realiza utilizando técnicas validadas que consisten en la combinación de la prueba de brentamina -la cual permite detectar la enzima fosfatasa ácida- y la prueba de inmunocromatografía -específica para la detección de proteína seminal humana P30-, al aplicar ambos procedimientos, el perito analista establece la presencia presuntiva de semen y de fluido seminal humano.
Por su parte, para individualizar a la persona a quien pertenece dicha muestra, es necesario realizar un análisis genético, en el cual a partir de Ácido Desoxirribonucleico (ADN) en calidad y cantidad adecuada, pueden detectarse perfiles genéticos útiles para cotejar con otros obtenidos de muestras de referencia.
Debido a que el semen no es un fluido biológico que pueda observarse fácilmente cuando ha sido depositado en un indicio, es recomendable utilizar técnicas que permitan orientar la búsqueda del mismo. Esto permite reducir tanto costos como tiempo efectivo de análisis, que al final contribuyen a hacer más eficiente el proceso de investigación criminal.
El fluido seminal posee la propiedad de emitir fluorescencia cuando es expuesto a radiación con longitudes de onda entre 350 y 500 nanómetros (nm). Dicha fluorescencia se relaciona con la composición del semen, principalmente con los aminoácidos tirosina y triptófano, la base nitrogenada flavina y también con la presencia de colina, que proviene de la vesícula seminal y se estima que se encuentra en una concentración de entre 11.2-14.4 mg/100mL de semen, considerando que durante cada eyaculación se produce entre 1.5 y 4mL de semen.
En este sentido, existe la posibilidad de realizar la búsqueda de fluido seminal, exponiendo los indicios a luz UV o a luz azul-verde. Dichas radiaciones son invisibles al ojo humano pero al ser absorbidas por la muestra, son reflejadas posteriormente con longitudes de onda mayor que corresponden al rango de la luz visible.
La posibilidad de utilizar de la lámpara de luz UV, que emite radiación a longitudes de onda entre 350-380nm, para la detección de fluidos biológicos data de 1,919 en Francia. Actualmente la misma es denominada Lámpara de Wood o Luz negra y permite observar una fluorescencia blanco-amarillenta en las regiones con posibles manchas de semen.
Otra alternativa para detección de semen es la utilización de la Lámpara Bretton, la cual emite radiación con longitudes de onda a 420-500nm y también es conocida como Luz azul o Luz forense.
Las manchas de semen expuestas a este tipo de luz y observadas directamente se perciben de color naranja, sin embargo, la técnica adecuada requiere la utilización de lentes que poseen un filtro anaranjado que permite observar específicamente la fluorescencia del semen y contribuye a eliminar la interferencia de la luz brillante producida por el material del indicio que contiene la muestra.
Con el objetivo de establecer la eficacia de la utilización de la Lámpara de Wood y la Lámpara de Bretton para la orientación en la búsqueda forense de fluido seminal, se realizó la comparación de los resultados obtenidos al exponer con ambas clases de lámparas, 20 diferentes tipos de textiles impregnados con una muestra de semen de referencia.
Asimismo, se evaluó la sensibilidad de los métodos al comparar los resultados obtenidos a partir de la aplicación de la muestra sin diluir y también diluida con agua destilada en factores de dilución de 1:2 hasta 1:256.
MATERIALES Y MÉTODOS
Equipo: fuente de iluminación de LED individual Crime-lite2® con longitud de onda azul 420-470 nm y fuente de iluminación LED individual Crime-lite 2® con longitud de onda UV 350-380nm, lentes protectores anti resplandor Crime-lite® con filtro anaranjado.
Muestra de referencia: Semen recolectado con dos horas de anticipación, almacenado a temperatura ambiente previo a la aplicación del mismo en los diferentes textiles. Diluido en agua destilada a temperatura ambiente, realizando diluciones seriadas de 1:2 hasta 1:256
Textiles utilizados: kiana, algodón, satín, fieltro, poliéster, lino sintético, dacrón-algodón, seda, podesua, lino, pelium fusionable, entretela de lana, teijin, gabardina, lona, teijin estampado, casimir, teijin gabardina, dacrón seda y pana sintética.
Instrumental: micropipetas de 2-20uL y de 100-1000uL, puntas para micropipeta de 2-20uL y 100-1000uL, pipetas plásticas con bulbo y tubos de vidrio.
Metodología: se preparó la muestra de semen de referencia en diluciones 1:2, 1:4, 1:8, 1:16, 1:32, 1:64, 1:128, 1:256, utilizando agua destilada a temperatura ambiente. Posteriormente, con una pipeta plástica con bulbo se aplicó una gota de la muestra de semen de referencia y de cada una de las diluciones en la superficie de los 20 diferentes tipos de textiles, cortados en segmentos de 3x3 centímetros.
RESULTADOS
Con ambos tipos de luz, se observó una disminución en la detección de fluorescencia a mayores diluciones de la muestra de referencia.
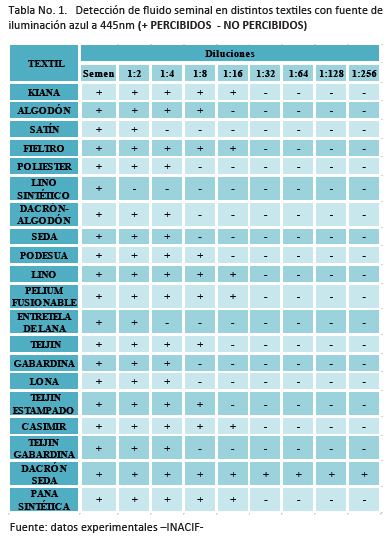 De acuerdo con esta tabla con la fuente de iluminación azul a 445nm se observó fluorescencia en todos los tipos de textiles, en el área donde fue depositada la muestra de semen de referencia sin dilución y en dilución 1:2, excepto el lino sintético, en el cual se observó fluorescencia únicamente con la muestra de semen sin dilución.En el poliéster, dacrón-algodón, seda, gabardina, lona y teijin-gabardina se observó fluorescencia únicamente hasta la dilución 1:4. En el algodón, podesua, teijin y teijin estampado se observó fluorescencia hasta la dilución 1:8.
De acuerdo con esta tabla con la fuente de iluminación azul a 445nm se observó fluorescencia en todos los tipos de textiles, en el área donde fue depositada la muestra de semen de referencia sin dilución y en dilución 1:2, excepto el lino sintético, en el cual se observó fluorescencia únicamente con la muestra de semen sin dilución.En el poliéster, dacrón-algodón, seda, gabardina, lona y teijin-gabardina se observó fluorescencia únicamente hasta la dilución 1:4. En el algodón, podesua, teijin y teijin estampado se observó fluorescencia hasta la dilución 1:8.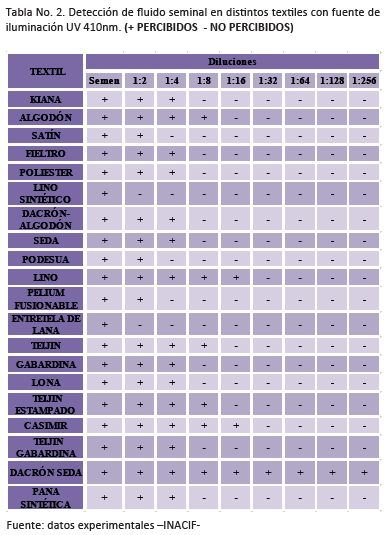 De acuerdo con la tabla citada, con la fuente de iluminación UV a 410nm se observó fluorescencia en todos los tipos de textiles en el área donde fue depositada la muestra de semen de referencia sin dilución y en dilución 1:2, excepto en el lino sintético y la entretela de lana, en los cuales se observó fluorescencia únicamente con la muestra de semen de referencia sin dilución.
De acuerdo con la tabla citada, con la fuente de iluminación UV a 410nm se observó fluorescencia en todos los tipos de textiles en el área donde fue depositada la muestra de semen de referencia sin dilución y en dilución 1:2, excepto en el lino sintético y la entretela de lana, en los cuales se observó fluorescencia únicamente con la muestra de semen de referencia sin dilución.
En la kiana, fieltro, poliéster, dacrón-algodón, seda, gabardina, lona, teijin-gabardina y pana sintética se observó fluorescencia únicamente hasta la dilución 1:4. En el algodón, teijin y teijin estampado se observó fluorescencia hasta la dilución 1:8.
A partir de la dilución 1:16 no se observó fluorescencia en ninguno de los textiles, excepto en el lino, casimir y dacrón-seda. Para el lino y el casimir esta fue la mayor dilución a la que se observó fluorescencia mientras que en el caso del dacrón-seda la fluorescencia fue observada incluso hasta la dilución 1:256.
 DISCUSIÓN
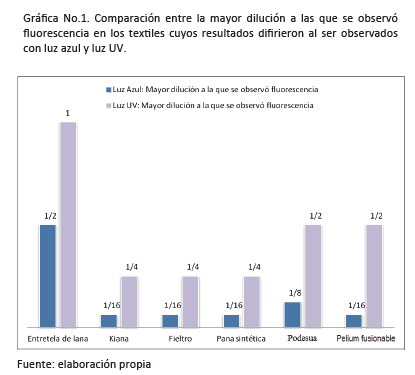
DISCUSIÓNDe acuerdo con los resultados obtenidos, en el 70% de los textiles analizados la dilución mayor a la que se observó fluorescencia fue la misma al utilizar la lámpara de luz azul que al utilizar la de luz UV. Únicamente con el dacrón seda se observó fluorescencia con ambas técnicas, incluso a la mayor dilución utilizada (1:256).En cuanto al 30% restante, que corresponde a entretela de lana, kiana, fieltro, pana sintética, podesua y pelium fusionable; la dilución mayor a la que se observó fluorescencia aumentó en un factor de 1:2 en 6 de los 20 textiles incluidos en el estudio al utilizar la lámpara de luz azul. Esto implica que la técnica de luz azul presentó una mayor sensibilidad frente a la técnica de luz UV, en dichos textiles, al ser utilizadas para orientar la búsqueda de presencia presuntiva de fluido seminal.La diferencia en la sensibilidad de las pruebas podría deberse a cuatro razones. La primera de ellas es la diferencia en la longitud de onda la que absorben energía de forma más efectiva los componentes fluorescentes del semen.En el caso de la tirosina y el triptófano el rango de absorbancia se encuentra entre 260-300 nm, mientras que en el caso de la flavina corresponde a 360-450 nm y de la colina a 430-500 nm. Por lo tanto la fluorescencia se ve favorecida al exponer las muestras con lámparas de luz azul (420-470nm).
La segunda razón es que la tirosina y el triptófano son aminoácidos, que pueden ser descompuestos fácilmente por microorganismos contaminantes provenientes del aparato reproductor masculino y del ambiente, en cuyo caso ya no podría contribuir a emitir fluorescencia.
La tercera razón, consiste en que la flavina y la colina presentes en el semen provienen de la fracción producida por la vesícula seminal, que corresponde aproximadamente al 60% del semen, una mayor concentración de los componentes que emiten fluorescencia de forma más efectiva al ser expuestos a la luz azul aumentan la sensibilidad de dicha técnica.
Por último, los lentes utilizados en la técnica de luz azul para evitar la interferencia producida por la luz brillante emitida por el soporte en el que se encuentra la muestra, permiten detectar concentraciones menores de fluido seminal al evitar la interferencia visual que pueda existir.
Además es importante tomar en cuenta que en todos los casos donde se observó fluorescencia, la misma se interpreta como presencia presuntiva de fluido seminal, debido a que otros fluidos biológicos como la orina y la sangre e incluso la presencia de bacterias como Pseudomonas fluorescens, que puede ser encontrada en suelo y agua no potable y en superficies que han estado en contacto con los mismos, pueden emitir fluorescencia al ser expuestos a luz azul o luz UV.
En consecuencia, todo resultado debe acompañarse de estudios posteriores que permitan determinar la presencia de fluido seminal y/o espermatozoides en los indicios analizados. De no observar fluorescencia utilizando la técnica de luz azul o luz UV, se recomienda proceder con los análisis para la determinación fosfatasa ácida a través de la prueba de brentamina (sensibilidad 1/10,000), proteína seminal humana P30 (sensibilidad 4ng/mL) y observación de espermatozoides a través de la tinción de árbol de navidad.
De acuerdo con la anterior tabla, los diferentes textiles que fueron utilizados pueden ser agrupados por su composición en fibras vegetales, animales, sintéticas o una combinación de las mismas. Sin embargo, comparando los resultados obtenidos no se observa un patrón relacionado a la composición de los textiles.
Esto es importante debido a que este tipo de pruebas se practican en soportes de toda naturaleza, incluyendo prendas como sábanas, ropa, ponchos, entre otros, compuestos de distintos materiales, y esto indica que la búsqueda de la presencia presuntiva de fluido seminal a través de la utilización de estas técnicas no es afectada por el tipo de fibras del soporte, reforzando la idoneidad de las mismas con fines forenses.
Las lámparas de luz azul y luz ultravioleta son de utilidad para la búsqueda en textiles de la presencia presuntiva de fluido seminal, incluso a diluciones de 1:256 en ciertos soportes. Utilizándolas en indicios de superficie amplia permite disminuir costos de tiempo y dinero, asociados a otras técnicas presuntivas utilizadas para el mismo fin.
La utilización de lámparas luz azul presentó un incremento en la sensibilidad en un factor de 1:2 en 6 de 20 textiles analizados (30%) para la búsqueda de la presencia presuntiva de fluido seminal, en comparación con la utilización de lámparas de luz UV.
La utilización de lámparas de luz azul y luz ultravioleta deben acompañarse de análisis posteriores para la determinación de fluido seminal y/o espermatozoides, incluso en los casos en los que no se observa fluorescencia.
La composición en cuanto a origen de las fibras (animal, vegetales o sintéticas) de los textiles, no influyen de forma evidente en los resultados obtenidos al utilizar lámparas de luz azul y luz ultravioleta para la determinación de la presencia presuntiva de fluido seminal.
De los 20 textiles que se incluyeron en este estudio, con ambas técnicas se observó fluorescencia en todos los textiles que contenían la muestra de semen sin dilución, mientras que el dacrón seda fue el único en el que se observó fluorescencia incluso a la mayor dilución utilizada (1/256).
Tomando en cuenta esto, no puede relacionarse con los resultados que puedan ser obtenidos en pruebas posteriores para la determinación de fluido seminal y/o espermatozoides, hasta realizar investigaciones específicas donde se evalúe su posible relación.
Química Bióloga
Universidad de San Carlos de Guatemala
Número de colegiada: 3074
Maestría en Ciencias Criminalísticas, Universidad Mariano Gálvez
Estudios de Maestría en Investigación Criminal, Universidad de Occidente
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Química Bióloga
Universidad de San Carlos de Guatemala
Número de colegiada: 3036
Maestría en Administración Industrial y Empresas de Servicio, Universidad de San Carlos de Guatemala
Maestría en Ciencias Criminalísticas, Universidad Mariano Gálvez
Estudios de Maestría en Investigación Criminal, Universidad de Occidente
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Licda. Ana Lucía Ovalle Morales
Química Bióloga
Universidad de San Carlos de Guatemala
Número de colegiada: 3832
Pensum Cerrado Maestría en Productividad y Ciencias de la Salud,
Universidad Galileo
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Guyton, A.C. & Hall, J.E. (2011). Tratado de Fisiología Médica. 12º edición. Editorial Elsevier. Barcelona, España.
Li, R. (2008). Forensic Biology. United States of America, CRC Press Taylor & Francis Group. Pp. 115-134
Marshall, S. Ms., Mr. A. Bennett & Dr. H. Fraval (2001). Locating semen on live skin using visible fluorescence. April. Melbourne Australia.
www.fosterfreeman.com/crime-lite2html, Noviembre 2014.
Kobus, H.J, Silenieks E. & Scharnberg, J (2002). Improving the effectiveness of fluorescence for the detection of semen stains on fabrics. Journal of Forensic Sciences 47(4) July. Pp. 819-823





